지난해 신약 승인 59건...1996년 53건 이후 최대
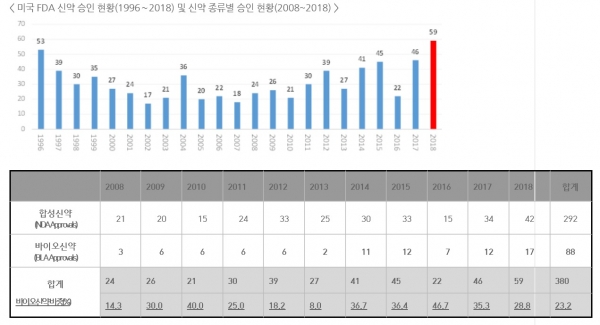
[스트레이트뉴스=윤대우 기자] 지난해 미국 FDA가 허가한 신약은 총 59건으로 이전 최대치였던 2017년 46건 보다 13건이 증가하며 역대 최다 승인건수를 기록했다.
12일 생명공학연구센터에 따르면 미국 FDA의 신약 허가건수는 2016년 22건에서 2017년 46건, 2018년 59건으로 늘었다. 트럼프 정부 출범 이후 추진된 의약품 규제 완화 정책의 영향이라는 분석이다.
이는 1996년 53건의 신약이 승인된 이래 최다 승인이며, 승인된 신약 중 바이오신약의 비중은 2014년 이후 30% 수준을 유지한 것으로 조사됐다.
특히 희귀질환 치료제 및 획기적 치료제 지정, 우선심사, 신속심사 등 신약개발 지원제도의 적극적 활용으로 신약 허가가 증가한 것으로 생명공학연구센터는 분석했다.
이러한 신약승인 증가는 환자에게 새롭고 혁신적인 치료법을 제공하고 희귀질환 및 전염병 등 공공성 및 미 충족인이 높은 질환에 대한 신약 허가가 많았던 것으로 조사됐다.
이처럼 지난해 미국 제약업체들은 트럼프 대통령의 규제완화 정책 덕을 톡톡히 보며 신약 승인 건수를 높였다. 미국의 신약 개발과 관련한 트럼프 효과는 미국의 바이오산업에 원기소로 작용한 셈이다. 한국 제약업계는 바이오 혁신 성장을 위해서는 규제 혁파가 선결돼야 한다고 주장하는 배경이기도 하다.
미국 제약업계의 발빠른 신약 개발은 트럼프 효과에 전격 기인한다. 도널드 트럼프 미국 대통령은 2017년 취임 이후 세계 신약시장 선점을 위해 의약품 관련 각종 규제를 철폐했다.
트럼프 취임 이전 미국은 유럽연합과 함께 신약 허가심사가 까다롭기로 유명했다. 트럼프 취임 이후 미국 식품의약국(FDA)는 신약의 임상 종료 후 최종 심사단계의 심사기간, 즉 심사허가 검토기간을 최대한 단축 중이다. 미국의 새 신약 허가 검토기간은 최근 12개월로 줄면서 신약 출시를 앞당기고 있다.